理化学研究所は、タンパク質の折り畳みを助ける分子シャペロンの1つ「ヒト型プレフォルディン(PFD)」が、アルツハイマー病の原因とされるアミロイドβの凝集を抑制し、低毒性化していることをマウスを用いた実験で発見した。これは、理研の基幹研究所(当時)前田バイオ工学研究室国際特別研究員のカリン ソルヤードゥ(Karin Sörgjerd)氏(現 理研脳科学総合研究センター 神経蛋白制御研究チーム研究員)、専任研究員の座古保氏、主任研究員の前田瑞夫氏、理研脳科学総合研究センター疾患メカニズムコア神経蛋白制御研究チームシニアチームリーダーの西道隆臣氏と、カナダ・サイモンフレーザー大学教授のミシェル ルー(Michel Leroux)氏らの共同研究グループによる成果。
アルツハイマー病発症の原因は、アミロイドβが脳内で凝集・蓄積することにあるとされ、アミロイドβの凝集抑制が有効な治療法になると考えられている。一方、分子シャペロン(タンパク質が正常に働くため,タンパク質を正しく折り畳むことを助ける一群のタンパク質)は、細胞にとって有害なタンパク質の凝集を抑制する働きがあるとされている。これまで研究グループは、分子シャペロン「PFD」の分子機構解明に取り組んできたが、ヒト型PFDがアミロイドβ凝集に対してどのような働きをするのかは不明だった。
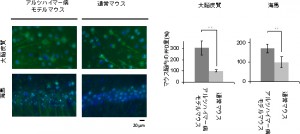
共同研究グループは、アルツハイマー病モデルマウスを用いて、脳内でのPFDの発現を調べたところ、通常マウスより多くのPFDを発現していることを確認した。次に、試験管内でヒト型PFDをアミロイドβと培養したところ、アミロイドβ凝集を抑制して可溶性オリゴマーが形成されることを見いだした。また、この可溶性オリゴマーの細胞に対する毒性を調べると、低毒性であることも分かった。
近年のアルツハイマー病研究では、可溶性オリゴマーの毒性が高い場合と低い場合の報告があり、この毒性が何に由来するのか不明だったが、今回の低毒性の可溶性オリゴマーと、過去に報告されていた高毒性の可溶性オリゴマーを比較した結果、抗体による認識が異なることが分かった。これは、それぞれの可溶性オリゴマーの表面構造が異なることを示し、可溶性オリゴマーの表面構造が毒性の鍵である可能性がある。
詳しくはこちら。