理化学研究所と東京大学は、バクテリアにおける「21番目のアミノ酸」と呼ばれるセレノシステイン(Sec)の合成メカニズムを解明した。これは、理研生命分子システム基盤研究領域領域長の横山茂之氏、東京大学分子細胞生物学研究所助教の伊藤弓弦氏らと米国イェール大学による共同研究成果。
老化防止や生活習慣病予防などに有効な元素のセレン(Se)は、ヒトを含む幅広い生物にとって微量成分として不可欠で、欠乏すると、がんや高血圧症を引き起こす。生体内ではSecの中に存在し、アミノ酸の配列を決める暗号(遺伝暗号)により、一部のタンパク質に取り込まれて機能する。Secは、専用の転移RNA(tRNA)であるtRNASecに結合した状態の別のアミノ酸を材料として合成されるが、ヒトを含めた真核生物とアーキアのグループ(ヒト型)とバクテリアのグループ(バクテリア型)では、その合成メカニズムが異なる。これまでヒト型については、その詳細が明らかになってきたが、バクテリア型については不明のままだった。
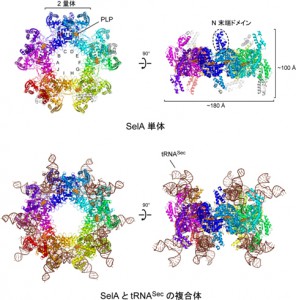
共同研究グループは、バクテリアにおいてSecを合成する酵素SelAとtRNASecの複合体の結晶構造を解析し、SelAが10個のサブユニットからなる超巨大な星形をしていることが分かった。また、サブユニットそれぞれの詳細な機能も明らかにし、星形を構成することが、Secの合成に必要不可欠であることも突き止めた。
この成果は、Se含有タンパク質の合成方法の開発に大きく貢献し、今まで不可能だった天然の酵素の機能を上回るスーパー酵素の創生や、Se欠乏を原因とする疾患の研究などに役立つと期待できる。
詳しくはこちら。