 東京農工大学と東京医科歯科大学は,糖鎖分子とともにタンパク質と反応しやすい求電子基を多数かつ高密度に修飾した金ナノ粒子を用いると,細胞抽出液中でも結合タンパク質との高効率・高選択的な架橋反応が起こり,結合タンパク質が同定できることを実証した(ニュースリリース)。
東京農工大学と東京医科歯科大学は,糖鎖分子とともにタンパク質と反応しやすい求電子基を多数かつ高密度に修飾した金ナノ粒子を用いると,細胞抽出液中でも結合タンパク質との高効率・高選択的な架橋反応が起こり,結合タンパク質が同定できることを実証した(ニュースリリース)。
糖鎖に結合するタンパク質の解明は,抗がん剤の開発や,糖鎖のがんとの関わりを理解するうえで重要となるが,糖鎖の結合タンパク質を迅速に微量で解析する方法は確立していない。
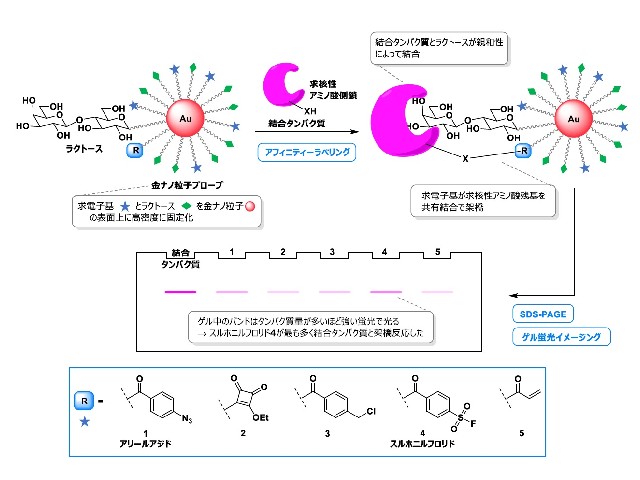
研究グループは,フォトアフィニティーラベリングとよばれる有機分子とタンパク質を光架橋する反応を用い,目的の糖鎖分子と結合するタンパク質を効率的に探索し,細胞内から簡便に精製する新しい方法を確立し,基盤技術として,金ナノ粒子表面に糖鎖分子と光反応基とを高密度に固定化したフォトアフィニティープローブを世界で初めて開発した。
金ナノ粒子の利点として,①糖鎖分子と光反応基をそれぞれ合成し,任意の比率で金粒子と混合するだけでプローブを作成できる。②糖鎖分子と光反応基の局所的濃度が高くなるため,タンパク質への親和性が増大し,反応性も向上する。③金ナノ粒子の比重を利用することで,遠心分離によって標的タンパク質の精製が可能となる。の3つがある。
従来,プローブの合成や架橋したタンパク質の精製に複雑な工程を要した。新しい技術は,これらの問題と,低親和性の糖鎖結合タンパク質の探索に解決策を示す一方,光反応基は非常に反応性が高く制御が難しいため,高い架橋効率を得るためには分子ごとに,プローブ設計の最適化が必要だった。
研究グループは,光反応基に代わる有望なタンパク質反応性基として,求電子基に着目。糖鎖分子と求電子基を混合して高密度に固定化した金ナノ粒子プローブを用いることで,結合タンパク質の選択的・効率的な架橋が可能と考えた。適切な求電子基を糖鎖分子の周辺にランダムにかつ高密度に配置するだけで高効率な架橋反応が実現できれば,分子ごとにプローブ設計を最適化する必要がなくなる。
実験ではモデル糖鎖分子であるラクトースと4種類の異なる求電子基および光反応基であるアリールアジドを金ナノ粒子上に固定化したプローブを作成し,3種類のラクトース結合タンパク質に対する反応性を評価した。その結果,スルホニルフロリドが,結合タンパク質を架橋するためのタンパク質反応性基として優れた反応特性をもつことを明らかにした。
さらに,スルホニルフロリドをタンパク質反応性基とした金ナノ粒子プローブは,光反応基によるフォトアフィニティーラベリングが有効でない場合でも,結合タンパク質の探索に利用できる可能性が示唆された。研究グループはこの成果が今後,結合タンパク質の網羅的な探索研究への応用や新たな創薬研究につながるとしている。