 横浜市立大学,筑波大学,大阪大学,京都大学,東北大学は,タンパク質に外来の抗原配列を移植して抗体を結合させる技術を開発した(ニュースリリース)。
横浜市立大学,筑波大学,大阪大学,京都大学,東北大学は,タンパク質に外来の抗原配列を移植して抗体を結合させる技術を開発した(ニュースリリース)。
タンパク質の立体構造解析は,生命現象の解明だけでなく,創薬においても非常に重要な研究手法となる。その解析において,抗体は有用な実験ツールとして用いられてきた。
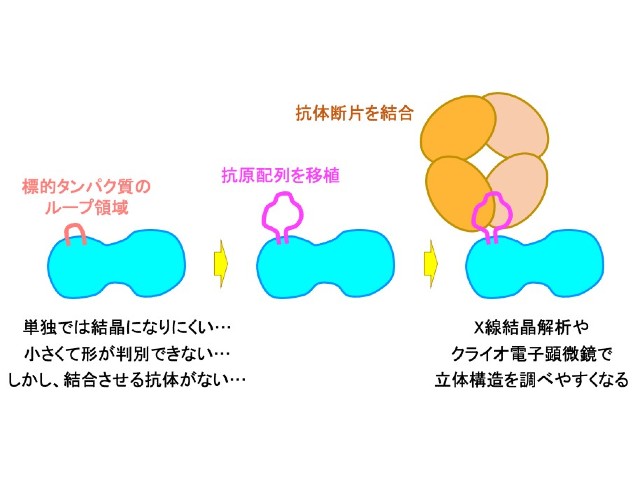
特にタンパク質の抗体によるラベリングは,X線結晶解析では,結晶になりにくいタンパク質の結晶化を促進させる効果があり,電子顕微鏡解析ではコントラストが低い画像から標的タンパク質を見つけ出す目印として役立つ。しかしながら,抗体でラベリングを行なうには,標的タンパク質を直接認識する抗体があることが前提で,適用範囲は限られていた。
この課題に対し,研究グループはこれまでに,「PAタグ」と呼ばれる12残基のアミノ酸配列を標的タンパク質に移植し,このPAタグと強固に結合するNZ-1抗体でラベリングする技術を開発した。
このPAタグの移植部位を最適化することで,標的タンパク質にNZ-1抗体が安定に結合することが示されたが,PAタグの移植やそのNZ-1抗体との結合によって標的タンパク質の一部の構造が変化してしまうことも明らかになっていた。
そこで今回の研究では,タグの長さを伸ばすことで移植した際の標的タンパク質の構造変化を抑えることを試みた。その結果,PAタグのN末端側にアミノ酸残基を2つ付け加えたPA14タグでは,標的タンパク質を天然の構造に近い状態に維持できることが示された。
標的タンパク質にPA14タグを移植してX線結晶解析を行なったところ,PA14タグはNZ-1抗体と結合すると末端同士が近づいてリング状の構造をとること,そしてNZ-1抗体が結合しても標的タンパク質の立体構造がほとんど壊れないことが確かめられた。
さらに分子動力学シミュレーションからも,PA14タグを移植した標的タンパク質の構造が安定に維持されることを確認した。そして,PA14タグを細胞膜の中で働くタンパク質に移植し,NZ-1抗体を結合させて負染色電子顕微鏡解析を行なうことで,標的タンパク質の構造情報を取得することにも成功した。
今回の研究から,PA14タグは標的タンパク質に移植して抗体を結合させるのに適した配列であることが確かめられたが,その一方で,標的タンパク質に結合したNZ-1抗体の向きが完全には固定されず,揺らぐ場合があることも分かった。
今後,標的タンパク質の構造を壊さずに抗体の向きを固定できるようになれば,クライオ電子顕微鏡などを用いて精密に立体構造を調べることが可能になるとしている。