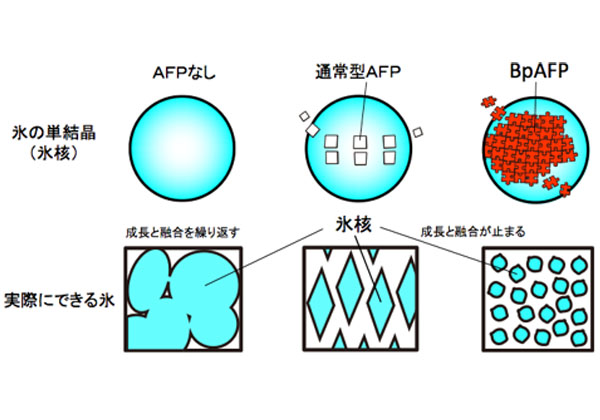
産業技術総合研究所(産総研)は,ニチレイと共同で,濃度に応じて分子同士が連結し,氷の結晶成長を止める新しいタイプの不凍タンパク質BpAFPを魚類から発見した(ニュースリリース)。
通常,タンパク質を水に溶かすときには塩や緩衝液を添加する必要があるがBpAFPは60%(質量パーセント濃度)もの高濃度で純水に溶ける。そこで,蛍光物質を付けたBpAFPの水溶液の中に球状に成形した氷の単結晶(φ=2cm)を入れて取り出し,蛍光を観測した。
その結果,濃度に応じてBpAFPが全ての氷結晶面への結合を進行させ,高濃度では氷結晶を覆い尽くす特別なAFPとして働くことを示した。この様に,濃度に依存して結合様式を変えるAFPは過去に報告例が無い。
次に,BpAFP水溶液を顕微鏡下で凍らせて氷核を調べてみると,BpAFPの濃度が高くなるに連れて先のとがったバイピラミッド型から丸みを帯びたレモン型に変化し,そのサイズも次第に小さくなって行くことが分かった。
また,氷結晶との結合力の指標である熱ヒステリシスの最大値は3.2℃であった。これは,既知AFPと比べても高い値であり,BpAFPが氷核の成長と融合を阻止する能力に優れることを示している。
分子構造について解析したところ,BpAFPは連続したアラニンを多く含むアミノ酸配列から成る比較的小さな分子であることがわかった。また,円偏光二色性測定からは,BpAFPが分子表面にスレオニン(T)を等間隔で配置したαらせん型構造を形成することがわかった。
沈降法の実験からはBpAFPが水溶液中で4量体や8量体を形成することがわかった。BpAFPは100℃に加熱後もαらせん構造を維持し,pH3~8の間で失活しない。これらの結果を総合的に解釈すると,BpAFPは水溶性に優れ,シンプルで安定性の高い分子構造を示し,連結して氷核の全表面を覆い尽くすことにより,氷核の結晶成長と融合を強く抑制すると考えられるとしている。
今後はこれまで冷凍保存が難しかった食品や細胞などにBpAFPを適用して,それらの品質や生命力に与える効果を明らかにし,特に,ガラス化保存液の成分としてBpAFPを活用する可能性について検討を行なう。また,ゲル化凍結技術やフリーズドライ技術など,氷核のサイズや形状が関係する他の冷熱利用技術に対するBpAFPの効果についても明らかにする。
研究では,BpAFPを高い精製度で取得する技術も開発することに成功した。この高精製度BpAFP試料には水の凍結や細胞の生死に影響をおよぼす塩や緩衝液成分が含まれていないため,希少性の高い試薬や移植用細胞などに対しても応用利用が可能と考えられるとしている。