 JST戦略的創造研究推進事業において,東京大学の研究グループは,アルツハイマー病の発症に関与するとされるアミロイドβペプチド(Aβ)の凝集体が持つアミロイド構造のみを区別して酸素化する光触媒を開発し,Aβの凝集と細胞毒性を抑えることに成功した(ニュースリリース)。
JST戦略的創造研究推進事業において,東京大学の研究グループは,アルツハイマー病の発症に関与するとされるアミロイドβペプチド(Aβ)の凝集体が持つアミロイド構造のみを区別して酸素化する光触媒を開発し,Aβの凝集と細胞毒性を抑えることに成功した(ニュースリリース)。
アルツハイマー病患者の脳には,老人斑と呼ばれるたんぱく質の沈着が認められ,この主成分はアミロイドβ(Aβ)と呼ばれるペプチドであることが知られている。
アルツハイマー病は,この老人斑が形成される際に生じるAβの凝集体が神経細胞を傷つけることで発症し,症状が進行すると考えられているため,Aβの凝集を抑える治療法の開発が盛んに進められている。
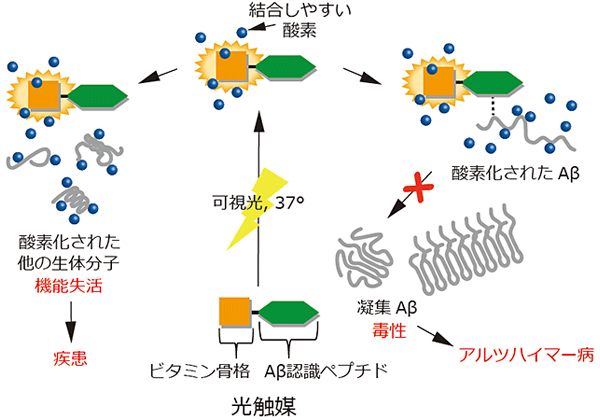
研究グループは,これまでにもAβを酸素化することで凝集を抑える光触媒(ビタミン骨格とペプチドの複合体)の開発に成功している。この光触媒に光を当てると,ビタミン骨格が結合しやすい酸素を持続的に発生し,Aβを認識するペプチドがAβの近くに導かれることで,Aβを酸素化する。
しかし,Aβだけではなく,生体内で重要な役割を果たしている他の生体分子も同時に酸素化してしまうという問題がある。そこで,研究グループは,生体内で他の生体分子に作用しない光触媒の開発を進めてきた。
研究グループは,光触媒が他の生体分子に作用しないためには,Aβに結合したときのみ酸素化を起こす光触媒が必要であると考えた。
一般に,Aβ凝集体には,クロスβシート構造と呼ばれる,Aβをはじめとするアミロイドたんぱく質に特有な構造(アミロイド構造)を持っている。この点に着目し,アミロイド構造を区別して結合する化合物をもとに酸素化を起こす光触媒を独自で設計,合成することとした。
開発した触媒とAβ凝集体の混合液に,生体内に近い環境(酸素下,中性溶液下,37度)で可視光を当てると,Aβ凝集体が酸素化される。一方で,生体内で重要な役割を果たす他の生理活性ペプチドは酸素化されておらず,この触媒がアミロイド構造のみを区別して酸素化することが分かった。
さらに,この触媒は,糖尿病に関連するアミリンやパーキンソン病に関連するα-シヌクレインなど,Aβ以外のアミロイドたんぱく質のアミロイド構造も区別して酸素化することが分かっており,これらの疾患の治療にも有効であると考えらるという。
また,Aβ凝集体が酸素化されることで,凝集体のさらなる凝集の進行が抑えられる可能性もわかった。さらに,Aβを認識するペプチドを結合させたこの触媒を細胞存在下で用いた場合,アミロイド構造を区別してAβの酸素化が進行し,Aβ凝集体による細胞毒性が軽減されることも明らかとなった。
研究グループは今後,この触媒を,可視光よりエネルギーの小さい光(長波長の光)でもAβ凝集体を酸素化し,凝集を抑えることのできる,さらに生体に適合したものへと改良を進める。また,実際の動物生体内でもAβの凝集と細胞毒性を抑えられるかを明らかにしていく。
将来,触媒反応を用いた新しいアルツハイマー病治療法へと展開できれば,触媒自体を医薬として利用するという新しい治療法を難治性疾患に提供できると期待している。
関連記事「産総研ら,アルツハイマーの原因タンパク質を可視化」「東大ら,アルツハイマーの進行を光遺伝学で解明」「可視光応答型ハイドロキシアパタイト系光触媒」






























