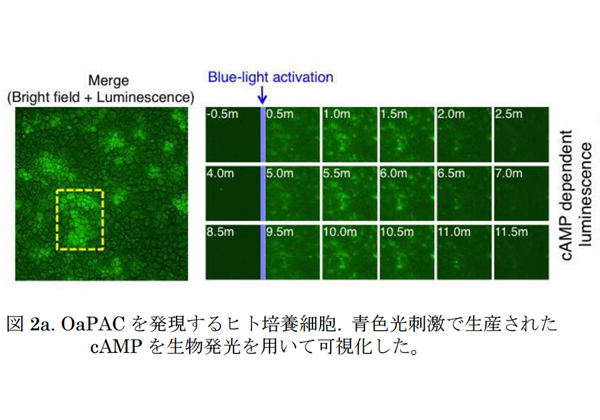
 横浜市立大学は,これまで原子レベルでの構造・機能解明がされていなかった光活性化アデニル酸シクラーゼ(PAC)について,ランソウ(藍藻)由来のPAC(OaPAC)を用いて構造を解明した。また,OaPACを用いて動物・植物に普遍的な情報伝達物質cAMP生産を光操作し,マウス海馬の神経軸索の分枝・伸長の誘導に成功した(ニュースリリース)。
横浜市立大学は,これまで原子レベルでの構造・機能解明がされていなかった光活性化アデニル酸シクラーゼ(PAC)について,ランソウ(藍藻)由来のPAC(OaPAC)を用いて構造を解明した。また,OaPACを用いて動物・植物に普遍的な情報伝達物質cAMP生産を光操作し,マウス海馬の神経軸索の分枝・伸長の誘導に成功した(ニュースリリース)。
光活性化アデニル酸シクラーゼ(PAC)は光センサータンパク質で,光を感知するとcAMP を作る ため,その生産量を光で制御できる。このため PAC は生体内での光スイッチとして医学的な応用が期待されている。
PAC はミドリムシから発見され,以後,複数の原核生物からも相同遺伝子が見出されていたが,これまで原子レベルでの構造・機能解明には至っていなかった。
この研究では光活性化アデニル酸シクラーゼ(PAC)の結晶化条件を探索し,ラン藻由来のOaPACを用いて暗所での結晶作成に成功した。OaPACの光活性化に伴う吸収スペクトルの変化を調べたところ,青色光受容体BLUFドメインの特徴である長波長シフト(445nm)が観測された。
溶液中でのスペクトル変化が結晶中でもほぼ同様に観測され,OaPACの光活性化は極めて小さな分子の動きにより起きていることが示唆された。OaPACの構造においては,非常に長く伸びたα3へリックスが目を惹く。この長いα3へリックスはフラビン色素からシクラーゼ活性中心に至る光シグナルの伝搬路としての役割を担うことが分かった。
このように,OaPACの活性調節ではBLUFドメインの極めて小さな変化が活性中心の構造変化を誘導するメカニズムが存在する。その分子メカ ニズムとして,研究グループは,coiled-coil構造を呈する2本のα3へリックスが産みだすアロステリック効果を提唱した。
研究グループは今後,今回得られた細胞の光操作の知見を基盤に,PACを活性化する刺激光に対する波長感受性の変換(マルチカラーツール化)や,細胞内信号伝達のメッセンジャー分子の光制御ツールの開発,さらには環状ヌクレオチドを分解する光操作ツールの開発など,バイオエンジニアリングでの展開を目指す。
また,オルガネラ単位での高精度な光操作法の開発や,トランスジェニック体を用いた生体での光操作など,より広範な光操作技術の確立にも努め,医療分野での新たな定番技術にしたいとしている。
関連記事「理研ら,分子混雑が計測できる蛍光タンパク質を開発」「阪大ら,肉眼観察できる明るい発光タンパク質を開発」「岡山大ら,細胞膜における電気の流れを光で自在に制御する人工タンパク質を創成」






























