 東京工業大学は,細胞外では発光せず,細胞に取り込まれると発光する新概念の蛍光性ナノ粒子を開発した(ニュースリリース)。1分子で独立していると発光し,凝集すると消光する蛍光色素(ナイルレッド)を,界面活性剤を使って凝集,固定して非発光性とし,生細胞内の還元条件の刺激によって凝集を解いて強力な蛍光を発光させる。
東京工業大学は,細胞外では発光せず,細胞に取り込まれると発光する新概念の蛍光性ナノ粒子を開発した(ニュースリリース)。1分子で独立していると発光し,凝集すると消光する蛍光色素(ナイルレッド)を,界面活性剤を使って凝集,固定して非発光性とし,生細胞内の還元条件の刺激によって凝集を解いて強力な蛍光を発光させる。
近年,「分子イメージング」のさらなる高性能化と実用化に向けたコストダウンが求められており,中でも蛍光性ナノ粒子(有機系のミセル,ナノ油滴,デンドリマーなど)の利用が盛んになっている。この方法は,(1)生体組織の非破壊的かつリアルタイムなイメージングが可能,(2)他のイメージング法(MRIやX線など)と比べ安価に実施できる,(3)ナノ粒子中に多数の蛍光分子を含むため,単一分子で染色する方法より高感度,(4)無機系ナノ粒子(量子ドット)と比べ細胞毒性が小さい―といった利点がある。
しかし,これまで知られている有機系蛍光ナノ粒子は,光安定性,安全性が十分でないものや,細胞に取り込まれていない粒子の発光による観察の阻害が起こるなど,実用に向けて改善・解決すべき問題が多数指摘されていた。
研究グループは,これらの問題点を克服するために刺激応答型蛍光ナノ粒子というコンセプトを提案した。このナノ粒子は,細胞に取り込まれる前には発光せず,細胞内の環境中で分解して発光するという発光のon・off機能(刺激応答性)を有する。この方法を使うと,観察対象の細胞だけを選択的にイメージング(染色)することができる。
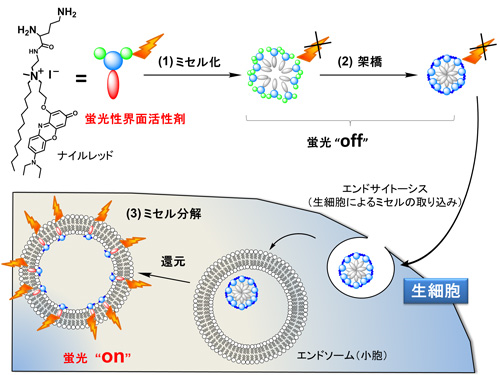
このナノ粒子は,ミセルと蛍光分子の特徴が巧みに組み合わされてできた。ミセルは,石鹸のように親水部分と疎水部分から成る分子が水中で会合して外部に親水部分,内部に疎水部分が揃った球状のナノサイズの集合体。合成が簡便で,疎水性の薬を封入するのに優れておりドラッグデリバリーシステムへの応用研究が進んでいる。
今回の研究では,すでに知られている生体適合性に優れたミセルを細胞内の還元条件下でのみ分解する架橋剤を用いて固定した刺激応答型ナノ粒子を作製した。
刺激に応答して発光する材料の設計では,ある蛍光色素が一分子で独立していると発光し,凝集すると消光するという性質を利用した。蛍光色素を疎水部に導入した界面活性剤を水中に入れると,ミセルを形成し,内部で色素が凝集して発光しない。このミセルを細胞内で分解して色素の凝集を解くと,強発光性を示す。
今回,ナイルレッドという赤色発光色素を用いて界面活性剤を作製,非発光性のミセルを作製した。次に,生細胞に内在する還元剤であるグルタチオンによって分解する架橋剤を用いてミセルを固定化し,非発光性のナノ粒子を得た。実際に生細胞内に取り込まれると分解が始まり,細胞をイメージングすることができる。
この蛍光ナノ粒子は,細胞内でのみ発光することが定量的に示されており,細胞内に取り込まれていないナノ粒子から発生する不要な蛍光が観察の邪魔をしていない。この水準のイメージングになると,バックグランドの補正の必要がなく,精度の高い診断を行なうことができる。
この蛍光ナノ粒子を,薬を患部まで運んでから放出するドラッグデリバリーシステムに応用すれば,薬が患部に到達していることの確認と薬の放出する様子をリアルタイムで観察することが可能になる。操作は簡単で,ナノ粒子を作る際にミセル内に薬を入れておき,架橋して封じ込めるだけ。
薬が患部まで届いていることの確認ができ,薬の放出速度を蛍光発光の変化から算出することができれば,薬の処方量が最適化でき,副作用を最小限に留めることができる。現在,研究は医学への応用へと進んでいるという。
関連記事「OIST,フェムト秒レーザを用いた標的型ドラッグデリバリーシステムを開発」「京都府大、標的たんぱく質に阻害薬を送り届けた後に立ち去る新規ドラッグデリバリー分子システムを開発」「NIMS,手で押さえるだけで薬が放出されるドラッグデリバリーシステムを開発」「名大ら,ゲルに柔軟な物性を与える架橋点が自由に動く架橋剤を開発」





























