 東京工業大学,東京大学らの研究グループは,芳香環のみが置換した「結合の手を2本しか持たないホウ素のカチオン化合物(ボリニウムイオン)」の合成に世界で初めて成功した(プレスリリース)。
東京工業大学,東京大学らの研究グループは,芳香環のみが置換した「結合の手を2本しか持たないホウ素のカチオン化合物(ボリニウムイオン)」の合成に世界で初めて成功した(プレスリリース)。
この化合物は,ホウ素がオクテット則(化学種を構成する元素の価電子数が8個になるように反応するという経験則)から著しく逸脱した電子不足化学種であり,これまで合成が極めて困難であるとされていた。
さらに,ボリニウムイオンを用いて,安化学的に安定な二酸化炭素から酸素を奪うという特異な反応性を示すことを実証した。これはボリニウムイオンの極めて高いルイス酸性(電子対を受け取る物質)により,二酸化炭素がユニークな活性化を受けたことを示すもの。
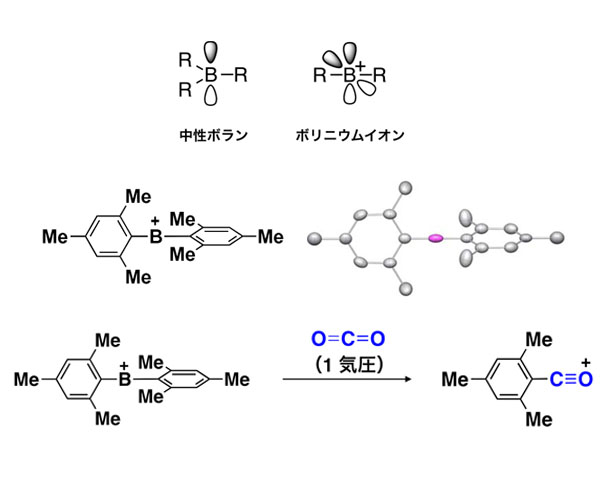
ホウ素化合物の性質や反応性は,その電子不足性とホウ素の低い電気陰性度に特徴づけられる。最も典型的なホウ素化合物は,中性三配位構造のボランである。この状態では,ホウ素は結合の手を三本持っている。この時,ホウ素上には空の2p軌道が存在し,ここに電子対を受け取ることで安定化する。すなわち,中性三配位のホウ素化合物はルイス酸として振る舞う。
研究グループは,ボリニウムイオンのデザイン戦略として,①ホウ素上の置換基として適度な立体障害をもつ芳香環であるメシチル基(2,4,6-トリメチルフェニル基)を用いること,および②対アニオンとして化学的に安定なアニオン種を用いることによって,芳香環のみが置換したボリニウムイオンの単離に初めて成功した。
ボリニウムイオンの詳細な分子構造は,各種分光分析に加え,単結晶X線構造解析により明らかにした。このボリニウムイオンは熱的に極めて安定であり,カルボラン塩の場合,結晶試料を300 ℃程度まで加熱しても分解しない。また,実験結果と理論化学計算の比較により,溶液,固体状態のいずれにおいても,ボリニウムイオンのホウ素中心は対アニオンや溶媒の配位を受けていないことが明らかとなった。
さらに,理論化学計算の結果,ボリニウムイオンの最低非占有軌道のエネルギー準位は、既存のホウ素化合物のものと比較して著しく低い -5.41 eV(電子ボルト)と算出された。これらの検討結果は,今回,合成したボリニウムイオンが熱力学的に安定でありつつも,同時に極めて高いルイス酸性を有していることを示している。
このボリニウムイオンの高い反応性を示す結果として,特異な二酸化炭素の活性化反応も見出した。ボリニウムイオンの溶液に二酸化炭素ガスを混合すると,二酸化炭素の炭素原子にボリニウムイオンのメシチル基が移り,かつ酸素を一つ失ったカチオン化合物が速やかに生成した。
すなわちこの反応では,二酸化炭素の酸素原子がホウ素により奪われている。この特異な反応は,強いルイス酸中心であるボリニウムイオンのホウ素原子が,二酸化炭素の酸素原子に配位することから進行すると考えられる。実際,理論化学計算による考察では,この反応機構がエネルギー的に妥当であることが示された。
この反応は,一般的に求核剤を用いて行われる二酸化炭素の活性化反応とは全く異なる。ボリニウムイオンを利用することで,今後,様々な基質をターゲットとしたユニークな分子活性化が可能になり,今後,「超ルイス酸分子化学」という新しい研究が加速するものと期待される。