理化学研究所と東京都医学総合研究所らの研究グループは,細胞内の巨大タンパク質分解酵素複合体「プロテアソーム」の細胞内動態を解析し,プロテアソームが細胞質で完成した後に核内に運ばれることを明らかにした。
プロテアソームは,ユビキチン化されたタンパク質を選択的に分解する巨大な酵素複合体。主に,細胞内のタンパク質恒常性の維持に中心的な役割を果たし,細胞周期制御や免疫応答,シグナル伝達などに関わっている。近年,プロテアソーム機能の破綻が神経変性疾患などさまざまな難治性疾患を引き起こすことや,プロテアソーム阻害剤が血液がんに有効であることが明らかになり,臨床面からも注目されている。
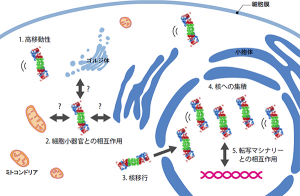
プロテアソームは約66個のサブユニットタンパク質で形成されるが,細胞内のどこで完成するのか,完成した複合体がどのように存在するのかなど,細胞内における性質や動態はほとんど分かっていなかった。
共同研究グループは,蛍光タンパク質(GFP,mCherry)をプロテアソームに結合させた酵母細胞を作製し,蛍光のゆらぎを測定する蛍光相関分光法を用いて生きた細胞内で直接その動態を解析した。その結果,ほぼ全てのサブユニットタンパク質は,完成したプロテアソームに取り込まれ,完成後は安定に存在すること,さらに細胞質や核内のプロテアソームの約半数は,何らかの細胞小器官や転写マシナリーと相互作用していることが明らかになった。
また,プロテアソームは核内で形成されると考えられてきたが,細胞質で完成した後に核に移行することが明らかとなった。動態が解明されたことから,今後,プロテアソームの動きを阻害する物質を発見できれば,創薬にもつながることが期待できる。
詳しくはこちら。