京都大学と東京大学らの研究グループは,がん化学療法の障害となっているABC多剤排出トランスポーターと非常によく似た構造と機能を示す膜タンパク質CmABCB1を温泉に棲む真核生物から発見し,その分子構造と多剤排出メカニズムを解明した。
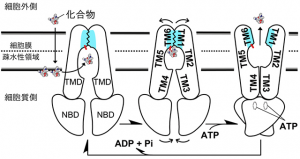
生物はトランスポーターという膜タンパク質を用いて細胞膜の内外の物質輸送を行なっており,中でもATP(アデノシン三リン酸)をその駆動エネルギーとして作用するものがABC(ATP Binding Cassette:ATP結合カセット)トランスポーターと呼ばれている。
特に有名なのがP糖タンパク質(またはMDR1)ともよばれるABCB1で,外界の異物から生体を守る役割を果たしている。一方で,経口投与された薬もABCB1によって体外へと排出されることから,ABCB1との相性が薬の効力と大きく関係している。
最初の抗がん剤治療で残ったがん細胞が,このABCB1を多数作ることによって多様な抗がん剤に耐性を獲得することが,化学療法の障害となっている。したがって,ABCB1の分子構造を解明することにより,この多剤排出という不思議な機能を解明することは,基礎科学的に重要なことはもちろん,創薬や医療にとっても重要な意義を持つ。
このABCB1のメカニズムを明らかにするために,世界中の研究者が結晶構造解析を30年近く試みてきましたが,ABCB1は細胞から取り出すと安定性が低く,詳細な分子構造の決定はこれまで不可能だった。
そこで研究グループは,シゾン(Cyanidioschyzon merolae)という温泉に棲む真核生物に着目し,ヒトABCB1と遺伝子配列の良く似たCmABCB1を発見した。さらにX線結晶構造解析の手法を用いて,その分子構造を詳細に解明することにより,多様な化学構造の分子を排出する仕組みを明らかにした。
研究グループは今後,CmABCB1で判明したことが,ヒトABCB1についても当てはまるかどうかの研究を進め,がんの化学療法を阻害する原因を解明し,抗がん剤などの創薬研究の進展や薬物治療の改良に役立てたいとしている。
詳しくはこちら。