岩手医科大学 解剖学講座助教の木村英二氏と基礎生物学研究所生物機能解析センター特任准教授の亀井保博氏ら研究グループは,赤外レーザ照射顕微鏡を用いて,ゼブラフィッシュの個体内で血管内皮細胞を対象に1細胞レベルで遺伝子発現を高効率に誘導することに世界で初めて成功した。
個体発生の過程で,血管系は決まったタイムコースに従い決まった形を作り上げていくが,これらの形態形成過程の制御メカニズムを明らかにするためには,個体内で時間・空間的に1 細胞レベルで目的遺伝子の発現を制御する必要があるが,既存の方法では十分にこれを達成することはできなかった。
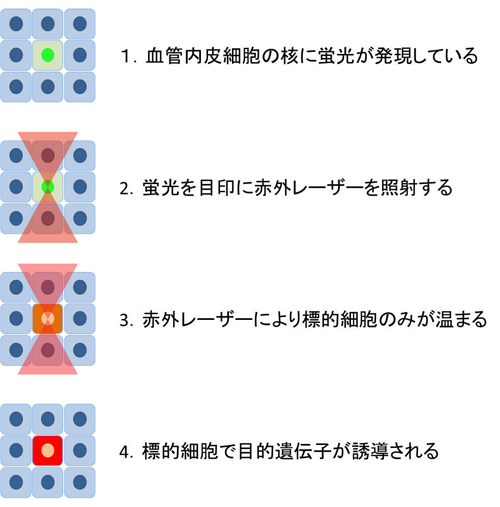
そこで一細胞で遺伝子発現誘導を可能にする赤外レーザ照射顕微鏡(IR-LEGO:
infrared laser evoked gene operator)を用い,これに成功した。IR-LEGO とは,赤外レーザを照射することで局所的に細胞を温め,熱ショックプロモーター下流の目的遺伝子の発現を誘導するシステム。
今回研究グループは,このシステムに血管内皮細胞の核で特異的に蛍光を発する遺伝子組み換えゼブラフィッシュを組み合わせることで,個体内の血管内皮細胞に効率よく赤外レーザを照射し,遺伝子発現を誘導できるシステムを構築。条件を最適化することで最大で60%の効率で,標的細胞の遺伝子発現が誘導された。
また,蛍光タンパク質を誘導することで,脳と脊髄の血管系がどのようにしてつながっていくのか,その連結に関わる細胞を明らかにすることにも成功。一方,赤外レーザの照射条件を変えることにより,瞬間的に細胞を破壊(焼却)することも可能となり,1 細胞レベルで発生途中の血管内皮細胞を破壊し,その後の形態形成への影響を評価することにも成功した。
血管系の形態形成メカニズムの理解が進むことで,将来的に再生医療やガン医療の進展に貢献することが期待される。今後は,形態形成に関与する遺伝子を選定し,このシステムを用いてその機能解析を進めていく。
詳しくはこちら。