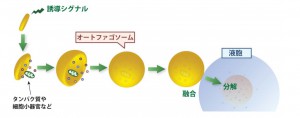
東京工業大学フロンティア研究機構特任教授の大隅良典氏らの研究グループは、細胞内の主要な分解システムの一つ、オートファジー(細胞の自食作用)に必須な因子の作用機構を分子・原子レベルで解明した。
対象のタンパク質を分解するのに必要なオートファゴソーム(タンパク質の袋)が形成されるには、「Atg8」というユビキチン様タンパク質(分解すべきタンパク質などの目印としてタンパク質に結合するユビキチンと立体構造が類似したタンパク質群の総称)が脂質分子と結合しなければならない。脂質と結合したAtg8が、オートファゴソームの材料となる脂質膜同士をつなぎあわせることで、膜の袋が形成されると考えられている。
Atg8と脂質との結合反応は「Atg3」という酵素によって触媒される。また、この反応は、オートファジーに必要なもう一つのユビキチン様タンパク質Atg12がAtg5と結合した「Atg12-Atg5結合体」によって促進される。しかしながら、Atg12-Atg5結合体がAtg3にどのように作用して、Atg8と脂質との結合反応を促進するのかは全く分かっていなかった。
今回、Atg12-Atg5結合体が存在しない時にはAtg3の立体構造は不活性型となっており、Atg12-Atg5結合体がAtg3に作用するとAtg3の活性中心の立体構造が変化して活性型となることを発見した。
近年の研究で、オートファジーが十分に機能しないと、神経変性疾患や肝疾患、癌、糖尿病などの原因になることが示唆されている。今回の研究で得られた情報をもとにAtg3やAtg12-Atg5結合体をターゲットとした予防薬や治療薬の開発が期待される。
詳しくはこちら。