 京都大学の研究グループは,RNA-Protein(RNP)相互作用を基盤とする機能性RNPナノ構造体を創製する技術の拡張と,高速原子間力顕微鏡(高速AFM)を用いたナノ構造体の構造変換過程の一分子観察に成功した(ニュースリリース)。さらに,標的乳がん細胞選択的に結合し,目的遺伝子の発現を抑制できる機能性RNPナノ構造体を開発することに成功した。
京都大学の研究グループは,RNA-Protein(RNP)相互作用を基盤とする機能性RNPナノ構造体を創製する技術の拡張と,高速原子間力顕微鏡(高速AFM)を用いたナノ構造体の構造変換過程の一分子観察に成功した(ニュースリリース)。さらに,標的乳がん細胞選択的に結合し,目的遺伝子の発現を抑制できる機能性RNPナノ構造体を開発することに成功した。
近年,DNAやRNAなどの生体高分子を活用してナノサイズの構造体を創製する研究が注目されている。最近,研究グループでは,RNP相互作用を基盤とするナノ構造体の設計と構築に成功した。
しかしながら従来の観察法では,溶液中におけるRNPナノ構造体の微細な構造や,RNP相互作用のダイナミクスを捉えることは困難だった。また,医療応用を見据えた,RNPナノ構造体による哺乳類細胞の機能制御も実現できていなかった。
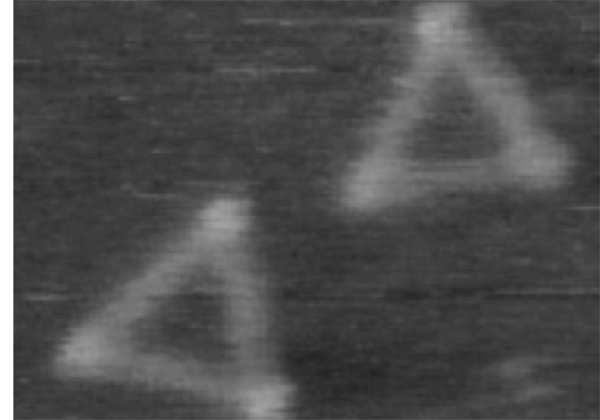
今回の研究では高速AFMを用いて,高解像度でRNPナノ正三角形を観察することに成功し,RNAナノ構造体がタンパク質との相互作用により構造変換する様子を直接観察することに成功した。
興味深いことに,フレキシブルな二本鎖RNA上の特定の3箇所に挿入したキンクターンRNA注3にリボソームタンパク質L7Aeが結合すると,ドーナツ状の柔らかなRNA構造体からリジッドな三角形構造体へと構造がダイナミックに変換した。
さらに,標的乳がん細胞を選択的に認識・検出する機能性RNPナノ構造体も創製した。特定の乳がん細胞表面上で発現しているHER2レセプターを特異的に認識するRNPナノ構造体を作製し,そのHER2発現量の異なる乳がん細胞へ投与したところ,このRNPナノ構造体は標的乳がん細胞を選択的に認識した。
今回創製したRNPナノ構造体は,細胞表面上で発現しているレセプターを選択的に認識することができるため,標的細胞へのデリバリーを可能とする。さらに,標的遺伝子の働きを抑制する(ノックダウンする)低分子二本鎖RNA(siRNA)をRNPナノ構造体に装着することで,細胞内で効率よく遺伝子制御を実現できることも見出した。
研究グループは,機能性RNPナノ構造体を創製するこの技術を応用することで,未分化細胞や標的がん細胞を選別し,選択的に細胞死を誘導する方法などへの応用が期待できるとしている。
関連記事「理研,発がんに関わるマイクロRNAが分解される仕組みを解明」「東工大,転写時のRNAの長さを制御する仕組みを明らかに」「大阪大,ALSや遺伝性脊髄小脳変性症などの発症の鍵を握るタンパク質が,RNAの安定性を制御することを発見」





























