 九州大学の研究グループは,インフルエンザウイルスが細胞内に侵入した際にウイルスによって作られる,ある部品(タンパク質)の働きで,ミトコンドリアの機能が著しく弱まる仕組みを,分子レベルで初めて解明した(ニュースリリース)。
九州大学の研究グループは,インフルエンザウイルスが細胞内に侵入した際にウイルスによって作られる,ある部品(タンパク質)の働きで,ミトコンドリアの機能が著しく弱まる仕組みを,分子レベルで初めて解明した(ニュースリリース)。
インフルエンザウイルスは細胞に感染すると,その細胞内でウイルスの部品となる様々なタンパク質やRNAを作りだし,新たなウイルスが複製される。一方,人体ではウイルスに対する免疫システムが働き,ウイルスの増幅を阻止しようとする。
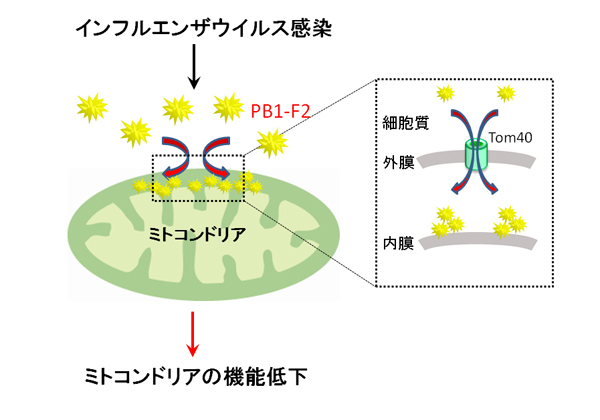
ミトコンドリアは,そのような免疫発動のプラットフォームとしても使われている。これまでにインフルエンザウイルスはPB1-F2と呼ばれるタンパク質を感染細胞内で作り出し,ミトコンドリアの機能に影響を及ぼしていることは明らかになっていたが,その詳しい仕組みはよく分かっていなかった。
今回,研究グループは,病原性の異なるインフルエンザウイルス亜型間で作られるPB1-F2タンパク質の長さの違いに着目して,ミトコンドリアとの親和性に関する詳細な解析を行なった。その結果,多くの高病原性(H5N1型)ウイルス間で存在しているタイプの90アミノ酸から成る長鎖PB1-F2は,特異的にミトコンドリアに運ばれている一方で,低病原性(H1N1型)ウイルスの主なタイプである57アミノ酸より構成される短鎖PB1-F2はミトコンドリアに局在できないことを明らかにした。
また、長鎖PB1-F2はミトコンドリア内に運ばれる際に,その入り口となるTom40チャネルタンパク質の中を経由して目的の場所に輸送され,その蓄積によりミトコンドリアの形態を異常化し,最終的に細胞の免疫応答における機能低下をもたらすことを発見した。
このようなミトコンドリアの異常は,低病原性ウイルスでみられるタイプの短鎖PB1-F2では確認できなかった。以上の結果より,PB1-F2はその長さに違いで細胞に及ぼす影響が異なっていることが明らかになった。
今回の結果より,インフルエンザウイルス感染後においても,PB1-F2 のミトコンドリア内への取り込みを制御することができれば,ミトコンドリアの機能維持,つまりは細胞の免疫機能を保持できることが示唆された。
研究グループはこの成果について,ウイルスタンパク質の細胞内での挙動を意図的にコントロールすることがウイルス感染による重篤化を防ぐ一つの可能性に繋がると期待され,今後そのような応用への発展が望まれるとしている。
関連記事「東京医科歯科大ら,赤血球からミトコンドリアが除かれるメカニズムを解明」「群馬大、東北大など、細胞性粘菌由来の抗がん剤候補物質がミトコンドリアの代謝機能を妨害することを発見」































