 北海道大学と大阪大学らの研究グループは,単純ヘルペスウイルスが宿主の免疫細胞から排除されることなく,体内へ入り込む巧妙な感染機構を解明した(プレスリリース)。
北海道大学と大阪大学らの研究グループは,単純ヘルペスウイルスが宿主の免疫細胞から排除されることなく,体内へ入り込む巧妙な感染機構を解明した(プレスリリース)。
単純ヘルペスウイルスは脳炎や口唇ヘルペス,性器ヘルペス,皮膚疾患,眼疾患,小児ヘルペスなど,多様な疾患を引き起こす難治性の病原性ウイルスで,日本だけでも年間約7万人が治療を受けていると言われる。特に,性器ヘルペスは既存の抗ウイルス薬では完治が不可能で,ヘルペス脳炎では致死的もしくは重度の後遺症が残る場合がある。単純ヘルペスウイルスの感染機構の解明は,これらの感染症を制御するうえで重要となる。
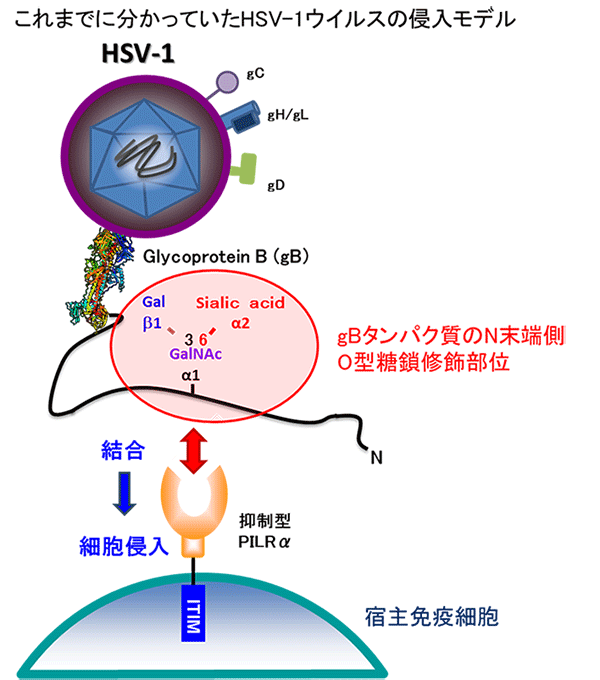
単純ヘルペスウイルスの表面にはさまざまな糖たんぱく質が存在し,その中でもglycoprotein B(gB)が,宿主の免疫細胞表面にあるPILRαたんぱく質と結合すると,それが免疫細胞の攻撃を抑えるスイッチの役割を果たし,単純ヘルペスウイルスは難なく細胞へ侵入する。しかし,それらの結合機構の構造的な基盤は解明されていなかった。
研究では,PILRαたんぱく質と,PILRαとgBが結合した複合体の立体構造を,SPring-8における解析により世界で初めて明らかにすることによって,原子レベルで結合機構を解明した。その結果,PILRαはこれまでgBの糖部分を認識していると考えられていたが,実際は糖部分とたんぱく質(ペプチド)部分の両方を同時に認識していた。さらに,PILRαたんぱく質に結合する7アミノ酸からなる糖ペプチドを加えると,PILRαたんぱく質を競合阻害し,単純ヘルペス感染を阻害できることが判明した。
PILRαは免疫系,神経系,ウイルス感染において幅広く機能を発揮しており,今回明らかとなった新しい認識機構は,ウイルス侵入メカニズムの理解や侵入阻害剤の開発だけでなく,PILRαによる広範な免疫の調節機構の理解とその調整薬やワクチンの効果を高める薬(免疫賦活化剤,アジュバント)の開発につながると考えられる。































